Проверка ряда методик приборного анализа природных вод в полевых условиях
Жилин Д.М.
Были сопоставлены результаты методик, использующих измерители с результатами, методик не использующих оных:
· рН – рН-метр и цветная индикаторная шкала
· щелочность общая – рН-метрическое титрование, кондуктометрическое титрование и титрование по индикатору
· хлорид-ионы – кондуктометрическое титрование и титрование по Мору
· кальций – потенциометрически (с коррекцией на ионную силу) и титрование ЭДТА по мурексиду
Кроме того, разумность показаний редокс-электрода контролировали по косвенным признакам (запах, соотношение Fe(II)/Fe(III), концентрация кислорода).
Анализ проводили школьники 10-11 биолого-химических классов под моим контролем.
Методики
рН по индикаторам. В эпендорфку отбирают пробу и добавляют из шприца 0.2 мл бромтимолового синего. Сравнивают окраску со стандартами в диапазоне рН 6.6-7.6. Если окраска похожа на окраску стандарта, рН этого стандарта и есть рН пробы. Если окраска похожа на окраску стандарта с рН 7.6, то аналогично определяют рН по тимоловому синему. Если окраска желтее, чем стандарта с рН 6.6 определяют рН аналогично по бромкрезоловому пурпурному. Если рН оказывается 5.2 и меньше — по бромкрезоловому синему. Меньше 4.6 — по бромфеноловому синему.
|
Интервал рН |
3.0-4.4 |
4.6-5.2 |
5.2-6.4 |
6.6-7.6 |
8.0-9.0 |
|
Индикатор |
бромфеноловый синий (БФС) |
бромкрезоловый синий (БКС) |
бромкрезоловый пурпурный (БКП) |
бромтимоловый синий (БТС) |
тимоловый синий (ТС) |
Общая щелочность по индикатору. В сосуд для титрования на 150 мл помещают 100 мл пробы и несколько капель раствора бромфенолового синего. Титруют 0.05М раствором HCl до начала перехода окраски в синий цвет.
Общая
щелочность ![]() .
.
Общая щелочность кондуктометрически. Титрование проводят в специальной полевой установке. В стаканчик под завинчивающуюся крышку набирают 100 мл пробы. Включают датчик проводимости в диапазоне 2 мСм/см, вставляют его в крышку и крышку навинчивают на стаканчик Титруют 0.05М раствором HCl (из шприца, воткнутого в крышку) до начала роста проводимости.
Общая
щелочность ![]() .
.
Общая щелочность рН-метрически. В стаканчик под завинчивающуюся крышку набирают 100 мл пробы. Вставляют в крышку рН-электрод и крышку навинчивают на стаканчик Титруют 0.05М раствором HCl (из шприца 10 мл, воткнутого в крышку, порциями по 0.2 мл). Записывают значение рН в зависимости от добавленного объема. За точку эквивалентности считают точку, после которой скачок был максимальным. Записи не выкидывают, а сдают начальству.
Общая
щелочность ![]()
Хлориды (Cl-) по хромату. В сосуд для титрования вносят 100 мл пробы, растворяют ~10 мг гидрокарбоната натрия, добавляют 1 мл 5% раствора K2CrO4 и титруют 0.01М раствором AgNO3 до появления оранжево-красной окраски.
![]()
Хлориды (Cl-) кондуктометрически. Титрование проводят в специальной полевой установке. В стаканчик под завинчивающуюся крышку набирают 100 мл пробы. Включают датчик проводимости в диапазоне 2 мСм/см, вставляют его в крышку и крышку навинчивают на стаканчик Титруют 0.01М раствором AgNO3 до начала роста проводимости в последнем знаке.
![]()
Кальций (Са2+) по мурексиду. В сосуд для титрования вносят цилиндром или шприцом 100 мл исследуемой воды. Добавляют 0.5 мл свежего концентрированного раствора NaOH, 3-4 капли Na2S 5% и мурексид (отсыпая в крышку, а из крышки — в сосуд для титрования) до заметно розовой окраски. Титруют из шприца на 10 мл при сильном перемешивании 0.025М раствором ЭДТА до перехода окраски из розовой в фиолетовую.
Концентрация
кальция 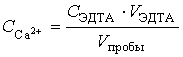 .
.
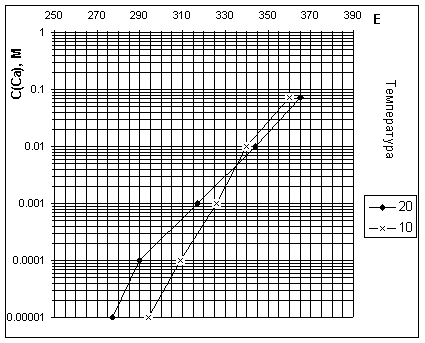
Кальций (Са2+) потенциометрчиески. В сосуд на 250 мл наливают пробу воды и погружают кальцийселективный электрод и электрод сравнения, подключенные к иономеру. Когда показания иономера установятся, записывают значение потенциала электрода и находят С(Ca) по градуировочному графику (температура 10°С)
Реактивы и оборудование
Электропроводность измеряли измеритель электропроводности L-Микро.
рН измеряли рН-метром L-Микро с рН-электродом сурьмяным внутрижелудочным.
Активность ионов кальция и редокс-потенциал измеряли при помощи иономера L-Микро с хлорсеребряным электродом сравнения. В качестве редокс-электрода использовали платиновую проволоку, впаянную в кончик стеклянной трубки. В качестве кальцийселективного электрода – электрод ЭЛИС-121Ca производства НПО «Измерительная техника».
Цветную шкалу для определения рН готовили в соответствии с инструкцией.
Кондуктометрическое титрование
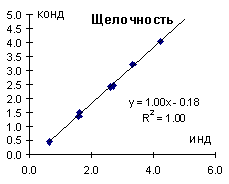
Кондуктометр вполне хорош для определения общей щелочности (Рис. 1) кондуктометрическим титрованием. Хотя процесс протекает несколько медленнее классического титрования так как требует постоянных записей (по крайней мере, для непривычных школьников).
Рис. 1. Сопоставление результатов определения общей щелочности кондуктометрическим титрованием и титрованием по индикатору.
С определением хлоридов кондуктометрическим титрованием возникли некоторые сложности. Здесь критичны отклонения в последнем знаке, а в нем кондуктометр иногда глючит. Поэтому, в частности, в трех точках из восьми определить концентрацию хлорид-ионов этим методом не удалось. Там, где удалось, сходимость с классическим методом вполне приличная (Рис. 3).
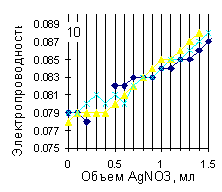
Рис. 2. Кривые кондуктометрического титрования хлорид-ионов нитратом серебра. Конечная точка титрования – 0.4 мл.
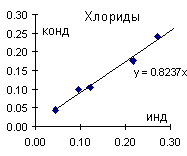
Рис. 3. Сопоставление результатов определения хлоридов кондуктометрическим титрованием и методом Мора
рН-метр
рН-метр с сурьмяным электродом дает довольно заметные расхождения с цветной шкалой (Рис. 4). Судя по всему, электрод плохо работает при низких температурах, ибо при нагревании воды расхождение уменьшается.
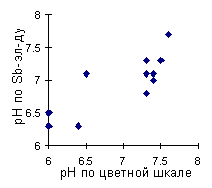
Рис. 4. Сопоставление результатов определения рН по сурьмяному электроду и цветной шкале
По удобству работы полевой рН-метр и цветная шкала вполне сопоставимы.
Что касается определения общей щелочности методом рН-метрического титрвания, то тут сурьмяный рН-метр вполне удобен и дает хорошо сопоставимые результаты с классическим титрованием (Рис. 5). При эторм с методической точки зрения рН-метрическое титрование наиболее информативно, так как позволяет школьникам по кривым рН-метрического титрования воочию убедиться в наличии у воды буферных свойств.
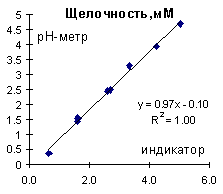
Рис. 5. Сопоставление результатов определения общей щелочности рН-метрическим титрованием и титрованием по индикатору
Кальцийселективный электрод
Даже предварительно прокалиброванный, не показывает никакой связи с результатами, определенными титрованием по мурексиду (Рис. 6). Поэтому для полевых условий неприменим.
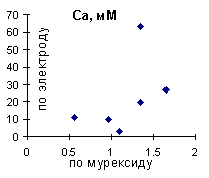
Рис. 6. Сопоставление результатов определения кальция ионселективным электродом (с коррекцией на ионную силу) и титрванием по мурексиду.
Редокс-электрод
1. Выходит на показания очень медленно (требуется не менее 15 минут).
2. Никакого разумного объяснения его результатам я не нахожу.